颅内动静脉畸形(AVM)以动脉和静脉间高流量的异常血管巢结合为特点。Lasjaunias等对AVM的血管构建进行研究,认为AVM的血管特点包括异常动脉,血管巢内血管瘤,血流相关性动脉瘤及出血源的曲张静脉。颅内AVM常有异常的血管形成及血管重建,因血管内缺乏正常的平滑肌,是发生破裂出血的原因。最新研究发现,早期出血、深部AVM、及相关动脉瘤的形成都是AVM出血的危险因素。
AVM的治疗方式取决于血管结构的特征、部位及症状表现。目前治疗AVM的方法主要有:显微外科手术、血管内栓塞及放射治疗。但是,尚无确定的结论证实哪一种方法最佳。AVM治疗的目标在于消除血管巢,降低异常血流量,使出血的风险减小。
显微外科切除颅内AVM,首先需要解剖出供血动脉并烧灼,完全阻断供血动脉之后,结扎引流静脉,才能称之为完全切除。传统的血管内介入,首先也要栓塞供血动脉,如果栓塞物提前进入引流静脉会引起灾难性的后果,如动脉怒张和大出血。放射治疗,尽管早期静脉阻塞的发生率很低,但发生后引起的后果同样很严重。
近期,美国斯坦福大厦神经外科学教授Choudhri等,在Neurosurgery杂志上,对经静脉入路栓塞治疗颅内AVM的发展起源,治疗优劣势,目前应用进展及未来发展等方面进行了详细的阐述。
经静脉治疗AVM的渊源
随着血管内介入技术的提高,20世纪80年代开始出现了经静脉入路治疗硬脑膜动静脉畸形的方法。Halbach等首先报道了经静脉栓塞硬脑膜动静脉瘘及颈内动脉海绵窦瘘的成功病例,随后,经各种静脉入路栓塞大脑大静脉畸形病例的相继报道,为经静脉入路治疗颅内AVM奠定了基础。
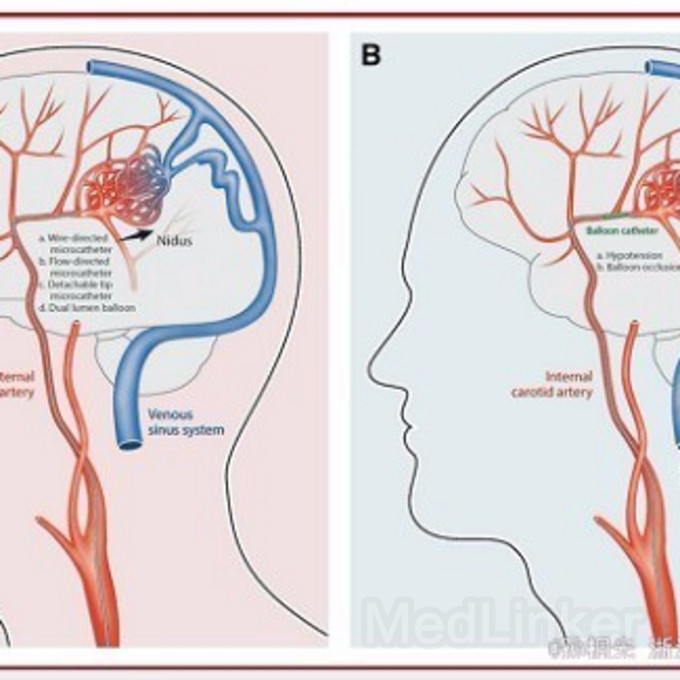
然而,经静脉入路治疗动静脉瘘的经验并不能成功的用于AVM。经静脉入路治疗颅内AVM面临的最大挑战是,需要在异常血管巢彻底栓塞之前不能阻塞引流静脉。
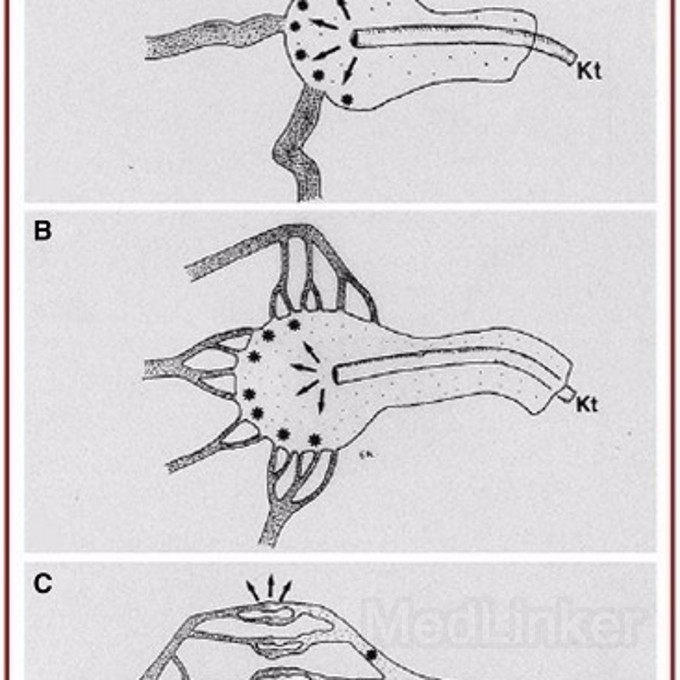
Houdart 根据动静脉畸形的血管特征,将其分为三类:动静脉之间血管巢内的大血管直接分流;其次,小动脉分支组成的滋养动脉经过血管巢分流到粗大的瘤样引流静脉;最后是小动脉分支组成的滋养动脉经过血管巢分流到小的众多的引流静脉。
神经外科医生在切除AVM的手术过程中,经静脉逆行结扎或栓塞引流静脉,避免了对AVM周围重要功能区的损伤。另外,经静脉入路治疗外周AVM的实施,也为治疗颅内AVM提供了经验。但经静脉入路能否治疗颅内动静脉畸形,仍因颅内AVM复杂的血管结构和引流静脉的类型不同而面临挑战。
试验模型
Massoud等首次建立了经静脉入路治疗颅内AVM的模型,在控制性低压状态下,经静脉入路逆行成功栓塞血管巢。说明,在控制性降压状态下,经静脉入路也可使栓塞剂到达AVM的血管巢内。
Massoud等后期利用猪为试验动物,制作了AVM模型,证实暂时性阻断供血动脉,经静脉注射造影剂后,可以增加血管巢内的充盈。这项试验为经静脉入路治疗颅内AVM迈出了很大的一步。
引流静脉的数目及大小对技术的影响
经静脉入路首先需要保证的是,在异常血管巢栓塞完全前,必须要保证引流静脉的通畅。从Massoud的动物模型,可以确定经静脉入路可以使栓塞剂进入血管巢而不发生反流。但是,保证治疗成功的关键是,静脉内微导管的放置位置要尽可能的接近血管巢,合适的控制血流动力学。
另外,了解AVM的引流静脉类型,可以预测静脉阻断后发生的后果。引流静脉的数目可能是影响手术安全的主要因素,有多条引流静脉的AVM,经静脉入路相对安全。但是,引流静脉的增多,也是血管巢栓塞不全的潜在风险增加。因此,还需要进一步的研究确定,血管巢大小及引流静脉的数目,对栓塞剂逆行弥散入血管巢的影响。
控制性降压程度
全身性或局部降低AVM血管巢的压力是经静脉入路手术成功的关键,能使栓塞剂克服供血动脉的压力弥散入血管巢。研究表明,全身性降压后,供血动脉内血流速度及血流量的降低与血管巢破裂出血之间存在相关性。术中和术后控制性降压仍是防止AVM出血和水肿的重要措施。
Iwama等报道了一例侧裂巨大AVM,通过诱导性降压、低温,降低血管巢内的压力,保证了AVM的成功切除。腺苷的使用可以明显地并一过性的降低全身血压,允许栓塞剂能控制性的进入AVM血管巢。
治疗AVM时,控制性降压的程度仍存在争议,血管巢两端的压力梯度,决定了栓塞剂逆行进入血管巢的量。
Massoud在其动物试验模型中,控制血管巢两端的压力为零,使栓塞剂进入血管巢。Young等研究控制性降压治疗AVM的机理时发现,栓塞治疗过程中,动态监测动脉和静脉的压力,可以灵活的调节全身的血压。另外,在逆行栓塞过程中,联合使用TCD血流监测和压力监测也是有帮助的。
另外一种使AVM血管巢内血流停止的方法,是球囊暂时性阻断供血动脉。球囊阻断供血动脉后,降低了静脉内的压力,提高了血管巢内栓塞剂的充盈。这种暂时性阻断血流的方法,降低了血管巢两端的压力梯度,使栓塞剂误流入扩张软膜血管的风险降低。
静脉血管解剖及穿通风险
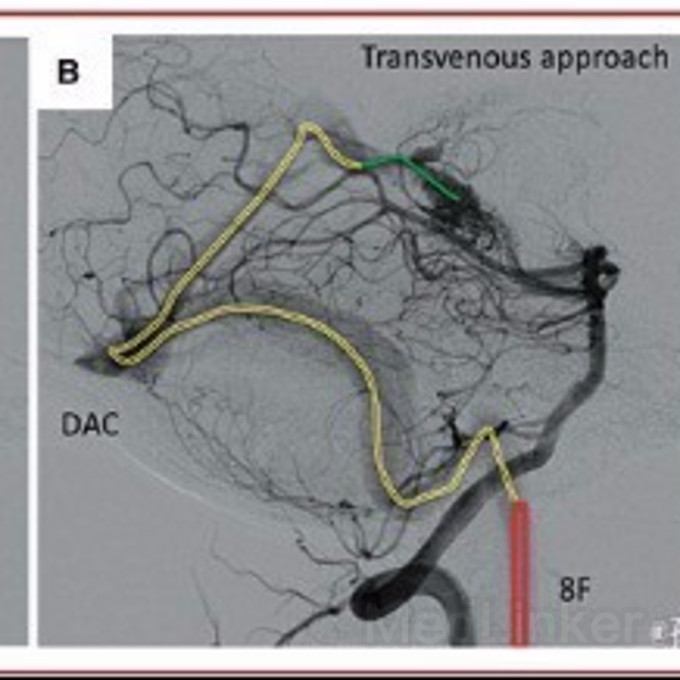
静脉血管的解剖变异较多,静脉导管需依血管迂曲走行而极度弯曲。另外,大脑皮层的静脉血管壁较薄,穿通可能性很高。动脉化的AVM静脉壁较厚,导管通过时相对安全。
尽管微导管和线圈技术,已能安全的用于大脑皮层静脉和深部静脉系统,但掌握静脉的解剖仍是至关重要的。在经静脉系统注射栓塞剂前,有动脉微导管和导丝护航意义重大。末端可分离微导管的使用,极大的降低了栓塞后撤离微导管时撕裂引流静脉的风险。
栓塞剂的选择
美国FDA允许用于颅内血管内栓塞的材料有:聚乙烯醇颗粒、乙醇、线圈、硅橡胶球体和丝线。
2005年开始,用乙烯-乙烯醇共聚物-Onyx治疗颅内AVM,这是一种缺乏粘性的栓塞剂,沿着血管分布后开始聚合。可在数分钟至数小时内注射,达到控制性栓塞的目的。乙醇用于血管内栓塞,在于其能够损伤血管巢内的内皮细胞,激活血栓的形成。α-氰基丙烯酸正丁酯是一种粘性聚合物,可在数秒内引起血管堵塞,不能用于动静脉栓塞。
随着非粘性液体栓塞剂的研究,用于经静脉入路治疗AVM的安全性仍待评价。已有报道,Onyx成功用于经静脉入路治疗硬脑膜动静脉瘘,但有时需要静脉内球囊辅助。
展望
目前,关于经静脉入路成功治疗AVM的病例很少,只是将其作为传统治疗方法失败后的补救方法。大多数传统治疗方法失败的AVM,位置较深,不适宜手术治疗,并且其出血倾向增加,供血动脉细小。
目前,血管内治疗颅内AVM的主要报道源于欧洲临床中心。Kessler发表了5例经静脉入路栓塞AVM的病例。所有患者表现为出血。4例患者AVM位于幕上。由于不能经动脉栓塞供血动脉,并且不适合手术和放射治疗,所以选择经静脉栓塞AVM。2例患者既往接受过放射和经动脉栓塞治疗。4例患者治疗后血管巢消失,栓塞剂首选Onyx。
Consoli等发表了Onyx经静脉栓塞小且位于深部AVM的经验,其中3例患者联合经动脉、经静脉入路,2例仅采用经静脉入路,治疗后所有患者的血管巢消失,无并发症发生。尽管这些报道说明经静脉栓塞AVM安全性及治愈率较高,但作者并不推荐将经静脉栓塞作为一线治疗方法。
Choudhri教授认为经静脉入路是治疗复杂AVM的一种新方法,尽管其与经动脉途径治疗AVM的原则不同,但两者的最终效果是相同的。目前,关于经静脉治疗AVM的临床及动物模型经验尚不足,因此,仅将经静脉入路用于特殊病例当中。
接受经静脉入路治疗AVM的患者,需要满足以下条件:
小的AVM(<2cm);AVM有明确的出血史;不适合手术治疗和放射治疗失败;不具备经动脉治疗的条件:供血动脉迂曲,丘纹动脉及脉络膜动脉供血;仅有单一的引流静脉;只能选择Onyx或其他非粘性栓塞剂;需要时可以临时阻断供血动脉;联合动脉导管,进行实时血管成像;进行全身控制性降压,最好可以监测血管巢内压力,降低压力差。
结论
经静脉入路栓塞AVM是一种逆行栓塞血管巢的方法。Onyx等新型栓塞剂在临床个别病例中的成功应用,提升了其在临床中治疗AVM的可靠性。
目前,经静脉治疗AVM的手术指证比较严格,这可能随着经验的积累会逐步改变。这项技术的不断应用,可以促使对我们进一步认识AVM的生理学特点,对未来血管内治疗AVM提供帮助。
本文转载自丁香园